Вважаєте, що хімічні сполуки з дивною назвою «алкани» використовуються лише під час наукових хімічних досліджень? Ви здивуєтеся, але з ними ми зустрічаємося щодня! Коли вмикаємо кухонну плиту, їздимо автомобільним транспортом, користуємося косметичними засобами. Що являють собою алкани, як їх правильно позначати та яка формула гомологічного ряду алканів? Про це і поговоримо!
Що таке алкани та де їх застосовують
Алкани (граничні чи насичені вуглеводні) – це сполуки, в яких всі атоми карбону з'єднані між собою і з атомами гідрогену простими (одинарними) зв'язками.
Алкани отримують з природних джерел: вугілля, торфу, деревини, нафти, природного газу та гірського воску. Їх використовують в різноманітних сферах життя та діяльності людини, зокрема в:
- енергетичній промисловості (виготовлення ракетного та моторного палива, побутового газу);
- хімічній промисловості (виготовлення розчинників, мастил, вазелінової олії та вазеліну, свічок, мийних засобів, лаків, емалей, мила, просочення сірників. Також використовують під час виробництва органічних кислот, спиртів, альдегідів, кислот тощо);
- косметології (виготовлення мазей та зволожувальних косметичних засобів, як пропеленти для виготовлення аерозолів абощо);
- будівництві (виготовлення асфальтових доріг);
- паперово-целюлозній промисловості (просочення пакувального паперу);
- харчовій промисловості (виробництво жувальних гумок).
Будова алканів
У молекулах алканів усі атоми карбону перебувають у стані sр3-гібридизації. Тобто всі чотири гібридні орбіталі атома однакові за формою, енергією та направлені в кути рівнобічної трикутної піраміди – тетраедра. Найпростішу будову серед алканів має метан (CH4).
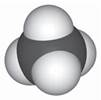
Молекули алканів мають такі особливості:
- у них присутні поодинокі сигма-зв'язки (σ-зв'язки), довжина яких становить 0,154 нм;
- валентний кут (між хімічними зв'язками) становить 109°28'.
Завдяки постійному обертанню атомів довкола простих σ-зв'язків, молекули алканів можуть набувати різних форм (їх ще називають конформаціями молекули). При цьому довжина зв'язку та кут між зв'язками залишаються постійними.
Загальна формула алканів
Загальні формули алканів виглядають так:
CnH2n+2, де n – ціле число атомів карбону.
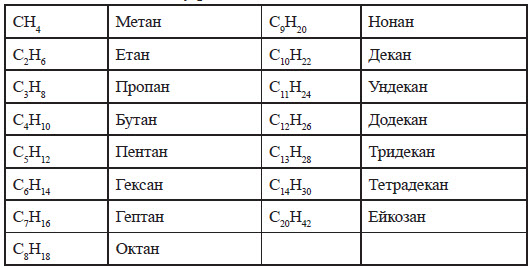
Загалом відомо 390 речовин, що належать до класу алканів. За міжнародною номенклатурою IUPAC за першими чотирма алканами (метан, етан, пропан, бутан) збережені їхні історичні назви, а починаючи з наступної, назви утворюються з:
- кореня грецької назви числівника, що відповідає кількості атомів карбону в ланцюзі (пент – п'ять; гекс – шість; гепт – сім; окт – вісім; нон – дев'ять; дек – десять);
- суфікса – ан.
Табличка алканів
Залежно від кількості атомів карбону виділено агрегатний стан алканів:
- С1-С4 – гази. Їх використовують переважно для опалення та приготування їжі, а в деяких країнах для виробництва електроенергії. Метан й етан – основні компоненти природного газу, пропан і бутан відомі як зріджений нафтовий газ. Пропан, наприклад, використовується в пропановому газовому пальнику, бутан – в одноразових запальничках;
- С5-С15 – рідини. Алкани від пентану до октану є досить летючими рідинами. Вони використовуються як паливо у двигунах внутрішнього згоряння та як розчинники для неполярних речовин. Алкани від нонану до гексадекану являють собою рідини з більш високою в'язкістю, тому складають основну частину дизельного та авіаційного палива;
- С16-С390 – тверді речовини. Ці алкани утворюють найважливіші компоненти рідкого палива та мастил. Багато твердих алканів знаходять застосування як парафіновий віск (наприклад, у свічках). Однак не слід його плутати зі справжнім воском, який складається здебільшого зі складних ефірів! Алкани з довжиною ланцюга приблизно 35 або більше атомів вуглецю використовують у дорожніх покриттях (бітумах).
Гомологічний ряд алканів
Гомологічний ряд – це послідовність подібних за своєю будовою та хімічними властивостями речовин, що відрізняються одна від одної на одну або кілька гомологічних різниць (ці сполуки називаються гомологами). Гомологічна різниця алканів відповідає одному атому карбону та двом атомам гідрогену – СН2. Першою сполукою гомологічного ряду алканів є метан.

Що таке ізомерія алканів і чим вона обумовлена
Ізомерами (грец. isomeros – складений із рівних частин) називають речовини, що мають одну молекулярну формулу, але відрізняються за будовою (структурна ізомерія) або за розташуванням атомів у просторі (просторова ізомерія).
Структурна ізомерія алканів обумовлена здатністю атомів карбону утворювати ланцюги різної будови. Цей вид ізомерії називають ізомерією карбонового ланцюга. У молекулах алканів відсутні функціональні групи та кратні зв'язки, тому їм властива лише ізомерія вуглецевого скелета.
Для алканів, починаючі з С4Н10 можуть існувати декілька структурних ізомерів. Наприклад, для С5Н12:
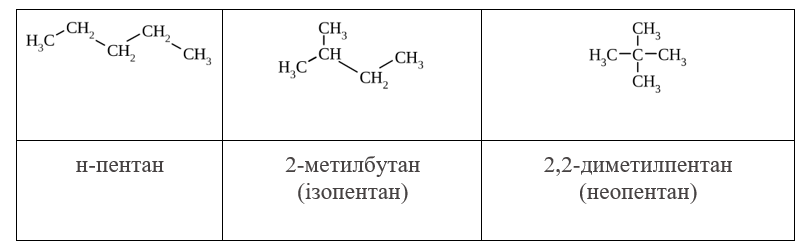
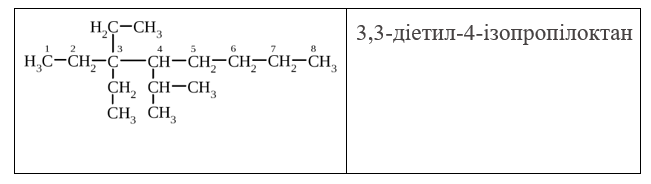
Для формування назви алкану, молекула якого має розгалужену структуру, варто дотримуватися таких правил:
- вибрати найдовший і найскладніший вуглецевий скелет;
- пронумерувати атоми карбону у головному карбоновому ланцюзі так, щоб отримати мінімальну суму номерів замісників;
- перерахувати замісники (радикали), вказуючи цифрами їх положення у головному карбоновому ланцюзі;
- назвати вуглеводень, який відповідає головному карбоновому ланцюгу.
Наприклад:
Хімічні властивості алканів
Завдяки тому, що всі валентності карбіду зайняті, хімічні властивості алканів не дуже яскраво виражені. У звичайних умовах алкани хімічно інертні та стійкі до дії багатьох реагентів: не взаємодіють з концентрованою сірчаною та азотною кислотами, з концентрованими та розплавленими лугами, не окислюються сильними окислювачами (КМnО4) тощо.
Реакції за участю алканів
1. Реакція повного окиснення (горіння). При горінні алканів виділяється велика кількість тепла й утворюються вуглекислий газ і вода:
2C2H6+7O2→4CO2↑+6H2O;
C7H16+11O2→7CO2↑+8H2O
2. Реакція неповного окиснення. Якщо кисню недостатньо, під час горіння утворюється карбон (II) оксид (чадний газ) або карбон:
2CH4+3O2→2CO↑+4H2O;
CH4+O2→C+2H2O
3. Реакція дегідрування (розкладу). При високій температурі без доступу кисню алкани розкладаються на карбон і гідроген (або ненасичені вуглеводні та водень):
CH4→C+2H2;
2CH4→C2H2+3H2;
C2H6→C2H4+H2
4. Реакції галогенування. Алкани не взаємодіють з йодом, проте реагують з фтором (із вибухом). Під час взаємодії з хлором і бромом (за умови освітлення або нагрівання) відбувається заміщення атомів гідрогену в молекулі алкана на атоми галогену:
C2H6+Cl2→C2H5Cl+HCl;
C2H5Cl+Cl2→C2H4Cl2+HCl;
C2H4Cl2+Cl2→C2H3Cl3+HCl.
5. Реакції крекінгу. Крекінг – процес розщеплення молекул алканів з розривом зв'язків між атомами карбону, який відбувається при високих температурах. У результаті утворюються ненасичені сполуки та алкани з меншою кількістю атомів карбону у ланцюгу:
C5H12→ CH4+C4H8;
C5H12→C2H6+C3H6;
C5H12→C3H8+C2H4
Суміш метану з киснем (в об'ємному співвідношенні 1:2) або повітрям (1:10) при підпалюванні згоряє з вибухом. Тому суміші метану, пропану, етану, бутану з повітрям дуже небезпечні!
Бажаєте опанувати шкільну програму та дізнатися багато цікавих лайфхаків? З онлайн-курсом «Підготовка до ЗНО з хімії» ви навчитеся аналізувати умови завдань та розв'язувати задачі всіх рівнів складності.
